中国科学院微生物研究所,中国微生物学会,中国菌物学会
文章信息
- 赵恬叶, 张梦梅, 陈媛, 王熙, 刘爱平, 何利, 邹立扣, 李建龙, 刘书亮. 2021
- Tianye Zhao, Mengmei Zhang, Yuan Chen, Xi Wang, Aiping Liu, Li He, Likou Zou, Jianlong Li, Shuliang Liu. 2021
- 食源米曲霉菌株的分离及其降解高效氯氰菊酯和3-苯氧基苯甲酸的特性研究
- Degradation properties of beta-cypermethrin and 3-phenoxybenzoic acid by food-derived Aspergillus oryzae strains
- 微生物学报, 61(9): 2693-2708
- Acta Microbiologica Sinica, 61(9): 2693-2708
-
文章历史
- 收稿日期:2020-10-12
- 修回日期:2020-12-28
- 网络出版日期:2021-01-14
2. 四川农业大学资源学院, 四川 成都 611130;
3. 四川农业大学食品加工与安全研究所, 四川 雅安 625014
2. College of Resources, Sichuan Agricultural University, Chengdu 611130, Sichuan Province, China;
3. Institute of Food Processing and Safety, Sichuan Agricultural University, Ya'an 625014, Sichuan Province, China
拟除虫菊酯类农药(pyrethroids,PYRs)是一类高效低毒的仿生杀虫剂,广泛运用于农业生产。PYRs具有相似的化学结构,包括氯氰菊酯、氟氯氰菊酯和甲氰菊酯等,其中氯氰菊酯在环境[1]、食品[2]和人体[3]中的检出率在PYRs中位居前列。氯氰菊酯的环境半衰期约为几十到几百天[4],对非靶标生物具有神经毒性[5]、生殖毒性[6]、免疫毒性[7]和致癌变[8]等毒副作用。氯氰菊酯分子含3个手性碳原子,有8种立体异构体,现市售主要为2个顺式异构体和2个反式异构体有效成分2︰3的混合物,即高效氯氰菊酯(beta-cypermethrin,β-CP)。3-苯氧基苯甲酸(3-phenoxybenzoic acid,3-PBA)是β-CP等PYRs在植物、昆虫和微生物细胞内代谢的主要中间产物[9],属于二苯醚结构类似物,具有与母体农药相似的生殖[10]和免疫[11]毒性。作为PYRs的生物标志物,3-PBA在人体中具有高检出率和检出水平,人体3-PBA残留对人体健康具有负面影响[3, 12]。研究表明,饮食是人体暴露PYRs和3-PBA的主要途径[13],因此食物链β-CP和3-PBA的修复研究对保护动物及人类健康具有重要意义。
微生物降解法因高效、生态和高安全性等特点被认为是较有潜力的毒害物质处理策略,其在治理一些异生化合物造成的环境污染如土壤、污水和原油污染修复上已有成效,如何将这一修复手段用于解决农副产品异生化合物残留污染是近年的研究热点。目前已报道的β-CP和3-PBA降解微生物多源自环境污染源,仅少数源自发酵食品,且降解微生物以芽孢杆菌属(Bacillus spp.)和假单胞菌属(Pseudomonas spp.)的细菌为主[9],丝状真菌作为二苯醚类物质如木质素和二噁英等的优势降解菌[14],相关研究较少。目前已报道的PYRs降解丝状真菌主要有米曲霉[15]、黑曲霉[16]、冠突散囊菌[17]、绿色木霉[18]、白腐菌[19]、草酸青霉[20]、枝孢菌[21]和小克银汉霉[22]等,其中分离自酱醅的米曲霉(Aspergillus oryzae) M4[15]、黑茶的黑曲霉(Aspergillus niger) YAT[16]、茯砖茶的冠突散囊菌(Eurotium cristatum) ET1[17]均可高效降解β-CP或3-PBA。米曲霉作为发酵工业重要的食品微生物菌种(microbial food cultures,MFCs),被美国食品药品监督管理局(FDA)列为一般公认安全(GRAS)菌种[23];欧洲食品安全局(EFSA)列为QPS (qualified presumption of safety)-推荐的食品生物制剂[24];同时也被我国列为食品用功能微生物菌种[25],对其开展农残减除研究具有较大的实践意义。目前针对米曲霉降解农残的研究,尤其是不同食源米曲霉菌株对β-CP和3-PBA的降解差异性研究鲜见报道。本研究以不同发酵食品为米曲霉筛选菌源,通过研究不同食源米曲霉菌株对β-CP和3-PBA的降解特性,了解菌株降解共性及差异性,为农副产品和发酵食品的农残减除提供理论基础和食品用安全微生物资源。
1 材料和方法 1.1 材料 1.1.1 实验菌种:菌样来源于四川阆中保宁醋厂醋醅,四川阆中保宁醋厂酱醅,四川郫县市售干霉豆瓣,四川丹棱徐氏霉豆瓣厂干霉豆瓣,山东济宁玉园生物科技有限公司发酵曲,山东临沂沂水锦润生物科技有限公司发酵曲,山东淄博沂源康源生物科技有限公司发酵曲,辽宁沈阳寿星生物科技有限公司发酵曲,上海酿造一厂发酵曲。米曲霉M4 (保藏编号:CGMCC 11645)由四川农业大学食品微生物实验室分离保存。米曲霉RIB40 (保藏编号:ATCC 42149)购自美国典型培养物保藏中心。黄曲霉(Aspergillus flavus) 3.4408 (保藏编号:CGMCC 3.4408)和寄生曲霉(Aspergillus parasiticus) 3.6156 (保藏编号:CGMCC 3.6156)购自中国普通微生物菌种保藏管理中心。
1.1.2 试剂:β-CP (99.8%,中国标准物质中心);β-CP原农药(96.8%,南京荣诚化工有限公司);3-PBA (98%,日本东京化成工业株式会社);3-苯氧基苄醇(3-PBlc,98%,阿拉丁);4′-羟基-3-苯氧基苯甲酸(4′-HO-3-PBA,95%,中国标准物质中心);苯酚(99.5%,阿拉丁);乙腈(色谱纯99.9%,瑞典oceanpak);2×T5 Direct PCR Kit (Plant)试剂盒(成都擎科梓熙生物技术有限公司);黄曲霉毒素B1胶体金测试卡(深圳芬德生物技术有限公司);其他试剂均为国产分析纯。
1.1.3 培养基:马铃薯液体培养基(PD):青岛海博生物技术有限公司;马铃薯葡萄糖琼脂(PDA):北京奥博星生物技术有限公司;麸皮培养基(WB):麸皮与超纯水等质量混合;基础盐培养基(MM):(NH4)2SO4 1.5 g,KH2PO4 0.5 g,K2HPO4·3H2O 1.5 g,NaCl 0.5 g,MgSO4·7H2O 0.2 g,超纯水1 L;富集培养基(GM):MM中加入10 g葡萄糖,超纯水1 L。孢子洗脱液:1 g Tween-80,1 g琼脂粉,超纯水1 L。以上培养基和孢子洗脱液121 ℃高压灭菌20 min。
1.1.4 主要仪器:高效液相色谱仪(LC-10A2010C HT型,日本岛津);气相色谱-质谱联用仪(Agilent 7890A-5975C型,美国安捷伦);液相色谱-质谱联用仪(Agilent G4214B-6120);冷冻离心机(Sorvall ST 16R型,美国Thermo Fisher Scientific);超纯水仪(Milli-Q型,德国密理博);PCR仪(C1000 Thermal Cycler型,美国Bio-RAD);凝胶电泳仪(PowerPac Basic型,美国Bio-RAD);凝胶成像分析系统(Gel Doc XR+型,美国Bio-RAD);光学显微镜(NLCD-307B型,NOVEL永新光学)。
1.2 菌株的形态学初筛及孢子悬液的制备用无菌生理盐水按10倍梯度稀释样品,取适宜稀释度样品匀液用PDA倾注平板,30 ℃培养24−36 h,用接种环挑取单菌落菌丝划线至再次得到单菌落,编号后划线PDA斜面,培养120 h得到菌株纯培养物,4 ℃保存。点植PDA平板,30 ℃培养5 d,观察菌落形态,同时采用乳酸石炭酸棉蓝浸片法观察菌体和菌核形态。初筛得到米曲霉疑似菌株。
用孢子洗脱液洗脱米曲霉PDA斜面制成孢子稀释液,采用血球板(XB-K-25)计数孢子数。调整孢子稀释液浓度至1.0×108 spore/mL,制备得到孢子悬液。
1.3 米曲霉疑似菌株的分子生物学鉴定分别吸取1 mL孢子悬液接种至装有30 mL PD的250 mL三角瓶,30 ℃、160 r/min振荡培养10 h得到菌丝体悬液,使用2×T5 Direct PCR Kit (Plant)试剂盒进行ITS的PCR扩增。取10 μL菌丝体悬液于2 mL离心管,加入50 μL lysis buffer A,95 ℃水浴30 min,2000 r/min离心1 min,取上清液作为PCR反应体系模板。ITS引物序列由成都擎科梓熙生物技术有限公司合成:ITS1:5′-TCCGTAGGTGAACCTGCGG-3′;ITS4:5′-TCCTCCGCTTATTGATATGC-3′。PCR反应体系(25 μL):2×T5 Direct PCR Mix (Plant) 12.5 μL,模板DNA 1 μL,ITS1、ITS4各1 μL,无菌超纯水9.5 μL。PCR反应条件:98 ℃ 3 min;98 ℃ 10 s,60 ℃ 10 s,72 ℃ 10 s,循环30次;72 ℃ 5 min;4 ℃保存。取5 μL PCR产物经1.2% (1×TAE)琼脂糖凝胶电泳分离,UV凝胶成像系统检测与成像。PCR扩增产物送成都擎科梓熙生物技术有限公司测序。将ITS测序结果在NCBI数据库中进行Blast比对分析,注册获得GenBank登录号。用MEGA X计算序列碱基组成和长度,Clustal W进行多序列比对,运用邻接法(neighbor joining,NJ)构建系统发育树,自举法(bootstrap values)对发育树分支进行1000次重复自检。
1.4 米曲霉菌株产黄曲霉毒素的检测采用胶体金免疫层析技术对菌株产黄曲霉毒素B1 (aflatoxin B1,AFB1)的能力进行测定。分别吸取1 mL孢子悬液接种至装有12 g WB的250 mL锥形瓶,30 ℃培养120 h,取2 g均匀培养物混合4 mL的70%甲醇,振荡混匀,室温4000 r/min离心5 min,取1 mL上清50 ℃氮吹浓缩至干,加0.25 mL的70%甲醇溶解,振荡2 min,加1 mL超纯水混匀,吸取60 μL样品液至加样孔,室温静置5 min。测定标准:阴性,T线显色(检测线)比C线(对照线)浅或一样深;阳性,T线不显色,检测下限5 μg/kg。阳性对照接种黄曲霉3.4408和寄生曲霉3.6156,阴性对照添加1 mL孢子洗脱液,每组两个平行。
1.5 米曲霉菌株降解β-CP和3-PBA的测定 1.5.1 农药标准曲线的绘制:采用HPLC法测定β-CP和3-PBA的保留时间(retention time,RT),根据峰面积(peak area,PA)绘制标准曲线,称取对照品溶解于乙腈,配制质量浓度为10.0、7.5、5.0、4.0、3.0、2.0、1.0、0.5 mg/L的系列标准曲线工作液,过有机滤膜(0.22 μm)用于检测,β-CP和3-PBA测定条件参照相关文献[26–27],色谱柱为Target WP-C18柱(120 Å,5.0 μm,4.60 mm×250 mm)。
1.5.2 米曲霉菌株在PD和MM中降解β-CP的残留测定:称取β-CP,用无水乙醇溶解配制5000 mg/L的β-CP母液(4 ℃贮存)。分别在PD和MM中加0.2% (W/V) Tween-80,灭菌冷却后加入1% (V/V) β-CP母液,得β-CP浓度为50 mg/L的β-CP-PD和β-CP-MM。分别吸取1 mL孢子悬液接种至装有30 mL β-CP-PD和β-CP-MM的250 mL三角瓶为实验组(EG),同时吸取1 mL孢子洗脱液至装有30 mL β-CP-PD和β-CP-MM的250 mL三角瓶为对照组(CG),每组3个平行,30 ℃,160 r/min振荡培养120 h后终止培养。发酵体系残留物质的提取方法参照有关文献[26–27],HPLC测定方法同1.5.1。降解率按公式(1)计算。

|
公式(1) |
式(1)中,ρ为发酵液底物残留质量浓度/(mg/L),ρ0为对照组底物质量浓度/(mg/L)。
1.5.3 米曲霉菌株在PD和MM中降解3-PBA的残留测定:准确称取0.05 g的3-PBA分别加入1000 mL PD和MM中,灭菌冷却得3-PBA浓度为50 mg/L的3-PBA-PD和3-PBA-MM。接种培养、发酵液残留物质的提取、HPLC测定和计算方法同1.5.2。
1.6 米曲霉菌株在GM中降解3-PBA的残留测定准确称取0.1 g的3-PBA加入1000 mL GM中,灭菌冷却得3-PBA浓度为100 mg/L的3-PBA-GM。接种培养48 h、发酵液残留物质的提取、HPLC测定和计算方法同1.5.2,同时利用GC-MS和LC-MS定性检测降解产物。GC-MS检测条件参照文献[28],色谱柱为Rtx-5MS,弹性石英玻璃毛细管柱(30 m×0.25 mm×0.25 μm),载气为氦气,进样口温度250 ℃,隔热吹扫流量3.0 mL/min,进样量1 μL,流速1.0 mL/min,程序升温条件为90 ℃保持4 min,6 ℃/min升温至150 ℃保持1 min,10 ℃/min升温至180 ℃保持4 min,20 ℃/min升温至260 ℃保持10 min。LC-MS检测条件,Target WP-C18柱(120 Å,5.0 μm,4.60 mm×250 mm),流动相乙腈-0.1%甲酸水(55︰45,V/V),流速1.0 mL/min,柱温25 ℃,进样量10 μL,干燥气温度350 ℃,干燥气流速12.0 L/min,雾化器压力35 psig,毛细管电压3800 V。
2 结果和分析 2.1 菌株的形态学鉴定从发酵食品中分离到35株霉菌,根据《中国真菌志》相关描述[29],参照米曲霉RIB40和米曲霉M4形态学特征,初筛得到15株米曲霉疑似菌株。
菌株菌落形态见图 1,培养5 d后菌落中央聚集呈丛状分布的菌丝,自内向外分生孢子颜色由绿色→黄色→白色,可见孢子环带呈同心圆分布。其中BC-3、BJ-3菌株培养10 d后可见菌落周围分布有深褐色硬质菌核(sclerotia),直径0.5−2.0 mm不等,单个或几个结群存在,表面附有无色透明渗出液。

|
| 图 1 米曲霉疑似菌株的菌落形态 Figure 1 Colonial morphology of suspected A. oryzae strains. |
以米曲霉M4菌体形态参照(图 2,A-H),分生孢子发育时体积增大,发芽后菌丝向两侧生长(A);菌丝有横隔膜,单个菌丝细胞可侧向发育形成新菌丝,发育成熟的菌丝细胞内可观察到液泡(B);部分菌丝特化生成连接分生孢子梗和营养菌丝的足细胞(C);分生孢子梗顶端膨大成近球形顶囊,少数分生孢子梗有横隔(D);极少数分生孢子梗顶端分支形成双顶囊(E);顶囊似层菌类菌柄和菌盖(F);顶囊表面长满单层辐射梨形小梗(G);顶端着生成串或成簇分生孢子,一个至几十个不等(H)。BC-3菌核形态如图所示(图 2,I-L),近球形硬质菌核表层附着透明黏液状物质(I),破碎菌核后可见其由外壁层和透明状内容物构成(J),外壁由一层连续、黑化、不规则拟薄壁细胞构成(K),内部由透明丝状菌体交织缠绕形成(L)。
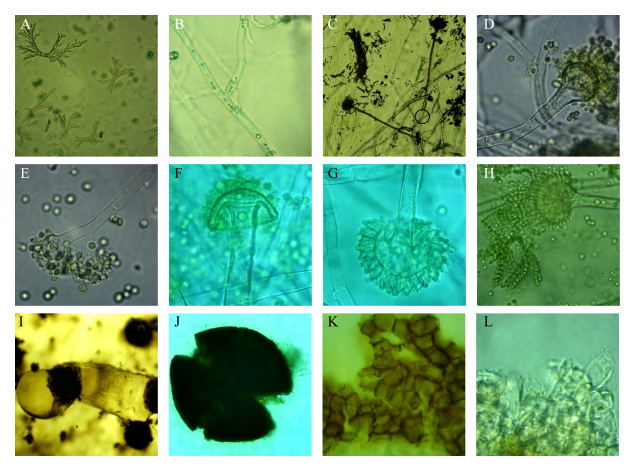
|
| 图 2 部分米曲霉菌株的菌体形态 Figure 2 Mycelial morphology of suspected A. oryzae strains. C, I: 200×; A, H, J: 400×; B, D, E, F, G, K, L: 1000×. |
2.2 菌株的分子生物学鉴定
菌株ITS的PCR扩增条带凝胶电泳成像如图 3所示,将扩增产物测序结果在NCBI中进行Blast比对,15株菌的ITS序列与米曲霉标准菌株ITS序列同源性 > 99.9%。NJ法构建的系统发育树见图 4,此15株菌与米曲霉ATCC 42149处于同一分支,同时与黄曲霉和寄生曲霉具有相对较近的进化亲缘关系。15株米曲霉ITS序列的GenBank登录号见图 4,各菌株ITS序列长度在560−581 bp,GC含量为56.7%−58.0%。测序结果的成功比对表明可利用2×T5 Direct PCR Mix (Plant)直接进行米曲霉ITS的PCR扩增,简化了霉菌ITS常规鉴定步骤。

|
| 图 3 米曲霉疑似菌株ITS的PCR产物 Figure 3 ITS PCR products of suspected A. oryzae strains. M: D2000 DNA marker. |

|
| 图 4 基于NJ法构建的菌株ITS rDNA序列系统发育树 Figure 4 Phylogenetic tree of ITS rDNA sequence of strains based on NJ method. Bold font: isolated strain; Numbers in bracket: GenBank accession number; T: type strain; development nodes show bootstrap value≥70%; scale bar represents 0.02 sequence divergence. |
2.3 菌株AFB1测定结果
米曲霉和黄曲霉同属曲霉属黄绿组,两者在形态学和基因组学上高度相似,是否产黄曲霉毒素是区别米曲霉和黄曲霉的关键[30]。同时,黄曲霉易污染农副产品,适宜环境条件下可产生强致癌、致畸的黄曲霉毒素,其中AFB1是目前已知致癌性最强、与人类健康关系最密切和污染水平最高的一种毒素,国家质检总局规定AFB1是大部分食品的必检项目,规定发酵食品AFB1含量 < 5 μg/kg,菌株是否产AFB1对菌株安全性评价具有重要的意义。本研究中,阳性对照黄曲霉3.4408和寄生曲霉3.6156的WB培养物检测到AFB1,阴性对照未检测到AFB1,实验组17株米曲霉的测定结果均为阴性。结果表明17株米曲霉WB培养物中AFB1的浓度低于检出限(5 μg/kg)或不含AFB1,此17株菌为食品用安全菌株,进一步鉴定为米曲霉。
2.4 不同食源米曲霉菌株在PD和MM中的β-CP和3-PBA的降解效果 2.4.1 β-CP和3-PBA的标准曲线:0.5−10.0 mg/L β-CP和3-PBA在确定HPLC色谱条件下的图谱见图 5,β-CP的1,2双峰RT值分别为9.887±0.018 min和10.432±0.018 min,分别对应β-CP反式和顺式异构体[31],拟合标准曲线方程y=61264x−1488.4 (R=0.9999),3-PBA的RT值为11.133±0.0079 min,拟合标准曲线方程y=108414x+4449.3 (R=0.9993)。β-CP原农药与标准品HPLC图谱一致。

|
| 图 5 β-CP和3-PBA标准品的HPLC图谱 Figure 5 HPLC chromatogram of β-CP and 3-PBA standard. A: β-CP; B: 3-PBA; 1: β-CP (trans); 2: β-CP (cis); a−e correspond to standards of 10, 5, 2, 1, 0.5 mg/L. |
2.4.2 不同食源米曲霉菌株在PD和MM中的β-CP降解情况:
17株食源米曲霉的β-CP降解率见表 1,米曲霉在PD中对50 mg/L β-CP的5d降解率为19.33%−50.29%,其中RIB40和M4降解率较高,分别为50.29%、42.99%。米曲霉RIB40的β-CP-PD体系中β-CP、3-PBA测定的HPLC图谱见图 6,米曲霉对β-CP的顺反异构体均有一定的降解能力,在米曲霉RIB40降解体系中检测到3*峰,加标测定结果显示3*物质为3-PBA,即米曲霉可断裂β-CP酯键生成3-PBA,与多数PYRs降解研究结果一致[9],在部分米曲霉M4降解体系中未检测到3-PBA,推测这些菌株可实现生成3-PBA的同步降解。β-CP-MM体系中振荡培养5 d,米曲霉均未生长,实验组和对照组β-CP残留浓度无显著性差异(P < 0.05),结果显示米曲霉以共代谢方式降解β-CP,即米曲霉不能将β-CP作为生长的唯一碳源和能源,需要在初级碳源存在下才能将β-CP作为次级碳源进行分解。
| Numbers | Concentration/ (mg/L) | Degradation rates/% | Capture of 3* |
| CG | 50.35±0.55 | / | − |
| BC-1 | 37.89±0.84 | 24.76±1.68 | + |
| BC-2 | 31.23±1.15 | 37.98±2.29 | + |
| BC-3 | 32.96±1.29 | 34.53±2.57 | − |
| BJ-1 | 32.76±1.88 | 34.93±3.73 | + |
| BJ-2 | 36.98±2.36 | 26.56±4.69 | − |
| BJ-3 | 38.50±1.24 | 23.54±2.46 | − |
| PX-1 | 31.52±1.16 | 37.41±2.31 | + |
| PX-2 | 32.96±0.17 | 34.54±0.34 | − |
| XS | 38.49±2.20 | 23.56±4.37 | − |
| JY-1 | 40.62±0.31 | 19.33±0.62 | − |
| JY-2 | 39.03±0.48 | 22.48±0.95 | − |
| JR | 33.89±0.46 | 32.68±0.92 | − |
| KY | 33.86±1.26 | 32.74±2.51 | − |
| SX | 35.03±1.65 | 30.43±3.28 | − |
| SH | 40.05±0.20 | 20.45±0.39 | − |
| M4 | 28.70±0.07 | 42.99±0.13 | − |
| RIB40 | 25.03±0.20 | 50.29±0.40 | + |
| CG: the control group; /: no data; +, −: capture, free of capture, respectively; Data were represented as mean±SD (n=3). | |||

|
| 图 6 米曲霉RIB40的β-CP-PD降解体系HPLC图谱 Figure 6 HPLC chromatogram of β-CP-PD degradation system by A. oryzae RIB40. A: β-CP determination; B: 3-PBA determination; 1*: β-CP (trans); 2*: β-CP (cis); 3*: 3-PBA; CG: the control group; EG: the experimental group; CG+3-PBA: the control group with 3-PBA standard added; EG+3-PBA: the experimental group with 3-PBA standard added. |
2.4.3 不同食源米曲霉菌株在PD和MM中的3-PBA降解情况:
17株食源米曲霉菌株的3-PBA降解率见表 2,米曲霉在3-PBA-PD体系中对50 mg/L 3-PBA的5 d降解率为45.59%−99.67%,普遍具有较高的降解率,以米曲霉M4降解率最高。其中有6株米曲霉降解率 > 80%,包括高产菌核米曲霉BC-3和BJ-3,研究表明菌核的产生是菌株对不良条件抗逆性应激的结果,产菌核菌株表现出较高的氧化还原酶活性[32-33],目前尚未有针对产菌核真菌降解农残的研究报道。米曲霉RIB40的HPLC图谱见图 7,3#峰为3-PBA,17株米曲霉均检测到5#峰的生成,未检测到同步生成的其他峰,且5#峰位于3-PBA右侧,初步推测5#物质为极性强于3-PBA的基团转化产物或者难降解断键产物之一。3-PBA-MM体系中振荡培养5 d,米曲霉均未生长,实验组和对照组3-PBA残留浓度无显著性差异(P < 0.05),结果表明米曲霉以共代谢方式降解3-PBA。
| Numbers | Concentration/ (mg/L) | Degradation rates/% | Capture of 5# | |
| CG | 50.48±0.75 | / | − | |
| BC-1 | 27.47±0.77 | 45.59±1.52 | + | |
| BC-2 | 20.20±0.58 | 59.99±1.15 | + | |
| BC-3 | 9.18±0.84 | 81.81±1.65 | + | |
| BJ-1 | 24.70±0.47 | 51.06±0.94 | + | |
| BJ-2 | 18.53±0.66 | 63.29±1.31 | + | |
| BJ-3 | 7.60±0.74 | 84.94±1.46 | + | |
| PX-1 | 10.72±1.09 | 78.76±2.16 | + | |
| PX-2 | 10.29±1.04 | 79.62±2.05 | + | |
| XS | 8.55±1.17 | 83.06±2.31 | + | |
| JY-1 | 9.18±1.04 | 81.81±2.06 | + | |
| JY-2 | 14.59±0.99 | 71.09±1.95 | + | |
| JR | 17.05±0.69 | 66.22±1.36 | + | |
| KY | 10.88±0.78 | 78.45±1.54 | + | |
| SX | 24.12±0.59 | 52.23±1.16 | + | |
| SH | 16.61±0.73 | 67.09±1.45 | + | |
| M4 | 0.17±0.12 | 99.67±0.23 | + | |
| RIB40 | 5.72±1.05 | 88.66±2.07 | + | |
| CG: the control group; /: no data; +, −: capture, free of capture, respectively; Data were represented as mean±SD (n=3). | ||||

|
| 图 7 米曲霉RIB40的3-PBA-PD降解体系HPLC图谱 Figure 7 HPLC chromatogram of 3-PBA-PD degradation system by A. oryzae RIB40. CG: the control group; EG: the experimental group; 3#: 3-PBA; 5#: intermediate products. |
2.5 不同食源米曲霉菌株在GM中的3-PBA降解效果
17株食源米曲霉的3-PBA的去除率见表 3,米曲霉在3-PBA-GM体系中2 d对100 mg/L 3-PBA均具有较高的转化或降解率。对比分析米曲霉菌株在3-PBA-MM和3-PBA-GM中降解测定结果,进一步确定米曲霉以共代谢方式降解3-PBA。米曲霉RIB40和M4的HPLC图谱见图 8,图谱中3′峰为3-PBA,检测到4′和5′峰(与3.6中5#峰RT值无显著性差异)。4′峰和5′峰的RT值均早于3′峰,未检测到同步出现的峰,且4′物质出峰时间接近3-PBA,可知4′物质是极性略强于3-PBA的基团转化产物,5′物质为极性强于3-PBA和4′物质的下游产物,根据米曲霉M4前期研究结果[15],推测4′物质是3-PBlc,5′物质可能是3-PBA羟基化产物或苯酚。
| Numbers | Concentration/ (mg/L) | Degradation rates/% | Capture of 4′ | Capture of 5′ |
| CG | 99.42±0.25 | / | − | − |
| BC-1 | 6.33±1.21 | 93.63±1.21 | + | + |
| BC-2 | 0.41±0.01 | 99.58±0.06 | + | + |
| BC-3 | 4.98±0.74 | 94.99±0.75 | + | + |
| BJ-1 | 5.94±0.14 | 94.02±0.14 | + | + |
| BJ-2 | 12.89±0.74 | 87.02±0.74 | + | + |
| BJ-3 | 5.28±0.14 | 94.69±0.14 | + | + |
| PX-1 | 0.44±0.10 | 99.56±0.10 | + | + |
| PX-2 | 1.08±0.33 | 98.92±0.33 | + | + |
| XS | 30.53±1.14 | 69.28±1.15 | + | + |
| JY-1 | 1.19±0.09 | 98.80±0.09 | + | + |
| JY-2 | 12.23±0.59 | 87.69±0.59 | + | + |
| JR | 1.35±0.08 | 98.64±0.08 | + | + |
| KY | 0.44±0.13 | 99.56±0.13 | + | + |
| SX | 0.49±0.12 | 99.51±0.12 | + | + |
| SH | 30.53±0.53 | 69.28±0.53 | + | + |
| M4 | 2.19±0.06 | 97.80±0.06 | + | + |
| RIB40 | 0.08±0.01 | 99.92±0.01 | + | + |
| CG: the control group; /: no data; +, −: capture, free of capture, respectively; Data were represented as mean±SD (n=3). | ||||

|
| 图 8 3-PBA-GM降解体系的HPLC图谱 Figure 8 HPLC chromatogram of 3-PBA-GM degradation system. A: A. oryzae RIB40; B: A. oryzae M4; CG: the control group; EG: the experimental group; 3′: 3-PBA; 4′: 3-PBlc; 5′: HO-3-PBA. |
利用GC-MS进行定性检测,以不添加农药的空白对照组图谱为参照,米曲霉M4发酵液总离子流谱图中检测到3-PBlc产物峰,质谱图见图 9,主要碎片离子峰m/z为200.08,与美国国家标准与技术研究院(NIST)质谱数据库中3-PBlc相似度≥98%。运用此方法可检测到苯酚标准品,但在降解体系中未检测到苯酚产物峰,即5′物质不是苯酚。同时利用LC-MS进行定性检测,以不加农药的空白对照组图谱为参照,米曲霉M4发酵液总离子流谱图中检测到3-PBlc产物峰,质谱图见图 10-A,主要碎片离子峰m/z 182.9 ([M+H+−H2O]+),与3-PBlc对照品一致。上述结果证实了米曲霉可将3-PBA转化生成3-PBlc的途径[15],目前在其他PYRs降解菌株中未观察到与此还原途径相似的降解途径,其转化机制尚不明确。另外在LC-MS中检测到HO-3-PBA产物峰(图 10-B),主要碎片离子峰m/z 230.9 ([M+H+]+),同时存在m/z 212.9 ([M+H+−H2O]+)的峰,此产物与4′-HO-3-PBA对照品的LC-MS图谱一致,但尚不能确定HO-3-PBA中羟基化的位点,推定米曲霉普遍具有实现3-PBA羟基化生成水溶性更强的HO-3-PBA的能力。

|
| 图 9 3-PBA-GM中米曲霉M4降解产物的GC-MS质谱图 Figure 9 GC-MS spectrum of metabolite produced by A. oryzae M4 in 3-PBA-GM. |
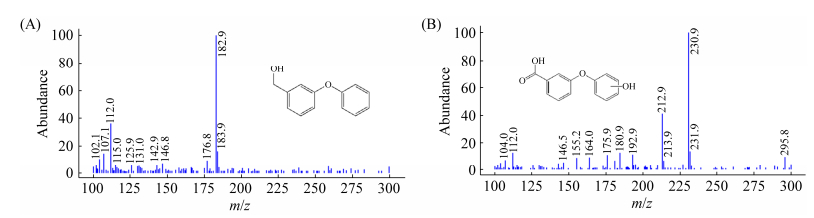
|
| 图 10 3-PBA-GM中米曲霉M4降解产物的LC-MS质谱图 Figure 10 LC-MS spectra of metabolites produced by A. oryzae M4 in 3-PBA-GM. A: 3-PBlc; B: HO-3-PBA. |
根据HPLC及降解产物质谱图分析,同时参照已报道的β-CP霉菌降解途径[15–22],推测了食源米曲霉的β-CP降解途径(图 11)。在食源米曲霉菌株作用下,β-CP首先断裂酯键生成3-PBA,3-PBA可被进一步氧化代谢,在降解3-PBA的初期,米曲霉均可实现3-PBA与毒性相对较低的3-PBlc的相互转化,此步反应与米曲霉M4前期研究结果一致[15],随3-PBA羟基化生成下游产物HO-3-PBA,3-PBlc进而氧化生成3-PBA,以实现3-PBA的完全降解。

|
| 图 11 米曲霉降解β-CP的预测途径 Figure 11 Proposed degradation route of β-CP by A. oryzae strain. |
3 讨论
饮食作为人体暴露接触β-CP等PYRs及3-PBA的主要方式,食物中异生化合物的解毒对保护人体健康具有重要意义。目前已筛选得到的β-CP及3-PBA降解微生物多分离自环境污染源,不适用于解决农副产品及发酵食品中的农药残留。本实验将一般公认安全的食品微生物菌种米曲霉作为目标筛选菌,以发酵食品作为菌株筛选来源,鉴定得到15株食源米曲霉菌株,首次对食源米曲霉RIB40、米曲霉M4和分离得到的米曲霉菌株的β-CP及3-PBA降解共性和差异性进行研究。结合β-CP-PD体系降解测定结果可知,食源米曲霉具有共代谢降解β-CP及其中间产物3-PBA的共性,不同米曲霉菌株对50 mg/L β-CP的5 d降解率为19.33%−50.29%,其中RIB40和M4降解率较高,分别为50.29%和42.99%,且米曲霉可同时实现β-CP顺反异构体的降解,3-PBA是主要中间产物,即米曲霉断裂β-CP酯键实现其降解。不同米曲霉菌株对3-PBA具有普遍较高的降解能力,5 d降解率为45.59%−99.67%,其中M4和RIB40降解率较高,分别为99.67%和88.66%。结果表明米曲霉M4和RIB40是β-CP及3-PBA的优良降解菌株。
为进一步阐释米曲霉对3-PBA的下游降解途径,利用营养成分更明确、背景峰更简单的GM培养基进行3-PBA降解研究。在3-PBA-GM体系中检测到4′和5′物质,结合GC-MS和LC-MS,4′和5′物质分别为3-PBlc和HO-3-PBA。一方面,食源米曲霉在3-PBA降解初期可将其短暂还原生成毒性相对较低的3-PBlc,与米曲霉M4前期研究结果一致,Zhu等推测与米曲霉自我保护特性相关[15],但机制尚不明确。另一方面,在3-PBA与3-PBlc相互转化的同时,米曲霉可实现3-PBA羟基化生成水溶性更强的HO-3-PBA参与下游降解。Maloney等在含氯菊酯的混菌体系[34]和芽孢杆菌(Bacillus stearothermophilus) SM4体系[35]中首次检测到4′-HO-3-PBA。Wang等[36]在苍白杆菌(Ochrobactrum tritici) pyd-1的甲氰菊酯降解体系中检测到4′-HO-3-PBA、原儿茶酸和对苯二酚,推测3-PBA首先羟基化生成4′-HO-3-PBA,进而断二苯醚键参与下游降解。Palmer-Brown[22]在小克银汉霉(Cunninghamella elegans) DSM1908的氯氟氰菊酯体系中同时检测到HO-3-PBA和(HO)2-3-PBA,推测由细胞色素P450催化上游酯键断裂的醇部分羟基化生成。另外在多株海洋真菌曲霉(Aspergillus sp.) CBMAI 1829、枝孢菌(Cladosporium sp.) CBMAI 1678、小球壳孢(Microsphaeropsis sp.) CBMAI 1675和青霉(Penicillium raistrickii) CBMAI 931[37–38]的PYRs降解体系中检测到HO-3-PBA,Tadkaew等[39]研究表明,异生化合物的羟基化可提高其水溶性和氧化还原电位,利于其被微生物细胞利用参与下游降解。结合本研究结果,推测3-PBA的羟基化是食源米曲霉实现3-PBA优势降解的关键。米曲霉是发酵食品工业应用广泛的有益真菌,论文研究结果表明目前发酵食品生产中应用的米曲霉菌株均有一定程度降解β-CP及3-PBA的能力,为深入研究发酵食品中残留PYRs的降解规律及安全性提供了理论依据。
| [1] | Tang WX, Wang D, Wang JQ, Wu ZW, Li LY, Huang ML, Xu SH, Yan DY. Pyrethroid pesticide residues in the global environment: an overview. Chemosphere, 2018, 191: 990-1007. DOI:10.1016/j.chemosphere.2017.10.115 |
| [2] | Skretteberg LG, Lyrån B, Holen B, Jansson A, Fohgelberg P, Siivinen K, Andersen JH, Jensen BH. Pesticide residues in food of plant origin from Southeast Asia-a nordic project. Food Control, 2015, 51: 225-235. DOI:10.1016/j.foodcont.2014.11.008 |
| [3] | Bao W, Liu B, Simonsen DW, Lehmler HJ. Association between exposure to pyrethroid insecticides and risk of all-cause and cause-specific mortality in the general US adult population. JAMA Internal Medicine, 2020, 180(3): 367-374. DOI:10.1001/jamainternmed.2019.6019 |
| [4] | Laskowski DA. Physical and chemical properties of pyrethroids. Reviews of Environmental Contamination and Toxicology, 2002, 174: 49-170. |
| [5] | Ali HFH, El-Sayed NM, Khodeer DM, Ahmed AAM, Hanna PA, Moustafa YMA. Nano selenium ameliorates oxidative stress and inflammatory response associated with cypermethrin-induced neurotoxicity in rats. Ecotoxicology and Environmental Safety, 2020, 195: 110479. DOI:10.1016/j.ecoenv.2020.110479 |
| [6] | Katragadda V, Adem M, Mohammad RA, Bhasyam SS, Battini K. Testosterone recuperates deteriorated male fertility in cypermethrin intoxicated rats. Toxicological Research, 2021, 37: 125-134. DOI:10.1007/s43188-020-00046-1 |
| [7] | He BN, Wang X, Zhu JB, Kong BD, Wei L, Jin YX, Fu ZW. Autophagy protects murine macrophages from β-cypermethrin-induced mitochondrial dysfunction and cytotoxicity via the reduction of oxidation stress. Environmental Pollution, 2019, 250: 416-425. DOI:10.1016/j.envpol.2019.04.044 |
| [8] | Huang F, Chen ZF, Chen HW, Lu W, Xie SJ, Meng QH, Wu YH, Xia DJ. Cypermethrin promotes lung cancer metastasis via modulation of macrophage polarization by targeting microRNA-155/Bcl6. Toxicological Sciences, 2018, 163(2): 454-465. DOI:10.1093/toxsci/kfy039 |
| [9] |
Deng WQ, Liu SL, Yao K. Microbial degradation of 3-phenoxybenzoic acid-a review. Acta Microbiologica Sinica, 2015, 55(9): 1081-1088.
(in Chinese) 邓维琴, 刘书亮, 姚开. 微生物降解3-苯氧基苯甲酸的研究进展. 微生物学报, 2015, 55(9): 1081-1088. |
| [10] | Sun H, Chen W, Xu XL, Ding Z, Chen XD, Wang XR. Pyrethroid and their metabolite, 3-phenoxybenzoic acid showed similar (anti)estrogenic activity in human and rat estrogen receptor α-mediated reporter gene assays. Environmental Toxicology and Pharmacology, 2014, 37(1): 371-377. DOI:10.1016/j.etap.2013.11.031 |
| [11] | Wang X, He BN, Kong BD, Wei L, Wang R, Zhou CQ, Shao YY, Lin JJ, Jin YX, Fu ZW. β-cypermethrin and its metabolite 3-phenoxybenzoic acid exhibit immunotoxicity in murine macrophages. Acta Biochimica et Biophysica Sinica, 2017, 49(12): 1083-1091. DOI:10.1093/abbs/gmx111 |
| [12] | Muñoz-Quezada MT, Lucero BA, Gutiérrez-Jara JP, Buralli RJ, Zúñiga-Venegas L, Muñoz MP, Ponce KV, Iglesias V. Longitudinal exposure to pyrethroids (3-PBA and trans-DCCA) and 2, 4-D herbicide in rural schoolchildren of Maule region, Chile. Science of the Total Environment, 2020, 749: 141512. DOI:10.1016/j.scitotenv.2020.141512 |
| [13] | Riederer AM, Bartell SM, Barr DB, Ryan PB. Diet and nondiet predictors of urinary 3-phenoxybenzoic acid in NHANES 1999-2002. Environmental Health Perspectives, 2008, 116(8): 1015-1022. DOI:10.1289/ehp.11082 |
| [14] | Dashtban M, Schraft H, Qin WS. Fungal bioconversion of lignocellulosic residues; opportunities & perspectives. International Journal of Biological Sciences, 2009, 5(6): 578-595. |
| [15] | Zhu YT, Li JL, Yao K, Zhao N, Zhou K, Hu XJ, Zou LK, Han XF, Liu AP, Liu SL. Degradation of 3-phenoxybenzoic acid by a filamentous fungus Aspergillus oryzae M-4 strain with self-protection transformation. Applied Microbiology and Biotechnology, 2016, 100(22): 9773-9786. DOI:10.1007/s00253-016-7847-3 |
| [16] | Deng WQ, Lin DR, Yao K, Yuan HY, Wang ZL, Li JL, Zou LK, Han XF, Zhou K, He L, Hu XJ, Liu SL. Characterization of a novel β-cypermethrin-degrading Aspergillus niger YAT strain and the biochemical degradation pathway of β-cypermethrin. Applied Microbiology and Biotechnology, 2015, 99(19): 8187-8198. DOI:10.1007/s00253-015-6690-2 |
| [17] | Hu KD, Deng WQ, Zhu YT, Yao K, Li JL, Liu AP, Ao XL, Zou LK, Zhou K, He L, Chen SJ, Yang Y, Liu SL. Simultaneous degradation of β-cypermethrin and 3-phenoxybenzoic acid by Eurotium cristatum ET1, a novel "golden flower fungus" strain isolated from Fu Brick Tea. MicrobiologyOpen, 2019, 8(7): e776. |
| [18] | Saikia N, Gopal M. Biodegradation of β-cyfluthrin by fungi. Journal of Agricultural and Food Chemistry, 2004, 52(5): 1220-1223. DOI:10.1021/jf0349580 |
| [19] | Hu KD, Peris A, Torán J, Eljarrat E, Sarrà M, Blánquez P, Caminal G. Exploring the degradation capability of Trametes versicolor on selected hydrophobic pesticides through setting sights simultaneously on culture broth and biological matrix. Chemosphere, 2020, 250: 126293. DOI:10.1016/j.chemosphere.2020.126293 |
| [20] |
Chen R, Qu J, Sun XY, Deng Y, Men X, Zhao LX, Shen WR. Isolation and identification of Penicillium oxalicum SSCL-5 degrading cypermethrin and its biodegradation. Biotechnology Bulletin, 2020, 36(6): 120-127.
(in Chinese) 陈锐, 瞿佳, 孙晓宇, 邓媛, 门欣, 赵玲侠, 沈卫荣. 氯氰菊酯降解菌草酸青霉SSCL-5分离鉴定及降解特性. 生物技术通报, 2020, 36(6): 120-127. |
| [21] |
Chen SH, Geng P, Hu MY, Li YN, Chen HT, Chen QG. Degradation characteristics and products of cypermethrin by Cladosporium sp. HU.. Scientia Agricultura Sinica, 2012, 45(3): 443-451.
(in Chinese) 陈少华, 耿鹏, 胡美英, 李亚楠, 陈慧婷, 陈清果. 枝孢霉菌HU降解氯氰菊酯的特性及其降解产物分析. 中国农业科学, 2012, 45(3): 443-451. DOI:10.3864/j.issn.0578-1752.2012.03.005 |
| [22] | Palmer-Brown W, De Melo Souza PL, Murphy CD. Cyhalothrin biodegradation in Cunninghamella elegans. Environmental Science and Pollution Research, 2019, 26(2): 1414-1421. DOI:10.1007/s11356-018-3689-0 |
| [23] | FDA. GRAS Notices. (2020-09-30). https://www.cfsanappsexternal.fda.gov/scripts/fdcc/?set=GRASNotices |
| [24] | EFSA Panel on Biological Hazards (BIOHAZ), Koutsoumanis K, Allende A, Alvarez-Ordóñez A, Bolton D, Bover-Cid S, Chemaly M, Davies R, De Cesare A, Hilbert F, Lindqvist R, Nauta M, Peixe L, Ru G, Simmons M, Skandamis P, Suffredini E, Cocconcelli PS, Escámez PSF, Maradona MP, Querol A, Suarez JE, Sundh I, Vlak J, Barizzone F, Correia S, Herman L. Scientific opinion on the update of the list of QPS-recommended biological agents intentionally added to food or feed as notified to EFSA (2017-2019). EFSA Journal, 2020, 18(2): e05966. |
| [25] |
Yao S, Yu XJ, Bai FR, Cao YH, Zhao T, Zhai L, Liu Y, Ge YY, Cheng K, Feng HJ, Ling K, Shi XM, Wang YF, Zhang XX, Cheng C. Research on the inventory of microbial species in Chinese traditional fermented foods. Food and Fermentation Industries, 2017, 43(9): 238-258.
(in Chinese) 姚粟, 于学健, 白飞荣, 曹艳花, 赵婷, 翟磊, 刘洋, 葛媛媛, 程坤, 冯慧军, 凌空, 史晓萌, 王永芳, 张小霞, 程池. 中国传统发酵食品用微生物菌种名单的研究. 食品与发酵工业, 2017, 43(9): 238-258. |
| [26] | Liu SL, Yao K, Jia DY, Zhao N, Lai W, Yuan HY. A pretreatment method for HPLC analysis of cypermethrin in microbial degradation systems. Journal of Chromatographic Science, 2012, 50(6): 469-476. DOI:10.1093/chromsci/bms030 |
| [27] |
Zhao N, Liu SL, Lai W, Yuan HY. Determination of 3-phenoxybenzoic acid in microbial degradation systems by HPLC-UV detection. Food Science, 2011, 32(14): 181-184.
(in Chinese) 赵楠, 刘书亮, 赖文, 袁怀瑜. HPLC-UV法测定微生物降解体系中3-苯氧基苯甲酸含量. 食品科学, 2011, 32(14): 181-184. |
| [28] | Tang J, Liu B, Chen TT, Yao K, Zeng L, Zeng CY, Zhang Q. Screening of a beta-cypermethrin-degrading bacterial strain Brevibacillus parabrevis BCP-09 and its biochemical degradation pathway. Biodegradation, 2018, 29(6): 525-541. DOI:10.1007/s10532-018-9850-0 |
| [29] | 齐祖同. 中国真菌志: 第五卷: 曲霉属及其相关有性型. 北京: 科学出版社, 1997: 78-85. |
| [30] | Jørgensen TR. Identification and toxigenic potential of the industrially important fungi, Aspergillus oryzae and Aspergillus sojae. Journal of Food Protection, 2007, 70(12): 2916-2934. DOI:10.4315/0362-028X-70.12.2916 |
| [31] | Hu W, Xie WB, Chen SH, Zhang N, Zou YP, Dong XL, Rashid M, Xiao Y, Hu MY, Zhong GH. Separation of cis- and trans-cypermethrin by reversed-phase high-performance liquid chromatography. Journal of Chromatographic Science, 2015, 53(4): 612-618. DOI:10.1093/chromsci/bmu094 |
| [32] | Marukawa S, Funakawa S, Satomura Y. Role of sclerin on morphogenesis in Sclerotinia sclerotiorum de Bary (including S. libertiana Fuckel).. Agricultural and Biological Chemistry, 1975, 39(3): 645-650. |
| [33] | 杜芳. 莱氏野村菌NADPH氧化酶基因家族的功能研究. 重庆大学硕士学位论文, 2018. |
| [34] | Maloney SE, Maule A, Smith ARW. Microbial transformation of the pyrethroid insecticides: permethrin, deltamethrin, fastac, fenvalerate, and fluvalinate. Applied and Environmental Microbiology, 1988, 54(11): 2874-2876. DOI:10.1128/aem.54.11.2874-2876.1988 |
| [35] | Maloney SE, Maule A, Smith ARW. Transformation of synthetic pyrethroid insecticides by a thermophilic Bacillus sp.. Archives of Microbiology, 1992, 158(4): 282-286. DOI:10.1007/BF00245246 |
| [36] | Wang BZ, Ma Y, Zhou WY, Zheng JW, Zhu JC, He J, Li SP. Biodegradation of synthetic pyrethroids by Ochrobactrum tritici strain pyd-1. World Journal of Microbiology and Biotechnology, 2011, 27(10): 2315-2324. DOI:10.1007/s11274-011-0698-2 |
| [37] | Birolli WG, Alvarenga N, Seleghim MHR, Porto ALM. Biodegradation of the pyrethroid pesticide esfenvalerate by marine-derived fungi. Marine Biotechnology, 2016, 18(4): 511-520. DOI:10.1007/s10126-016-9710-z |
| [38] | Birolli WG, Vacondio B, Alvarenga N, Seleghim MHR, Porto ALM. Enantioselective biodegradation of the pyrethroid (±)-lambda-cyhalothrin by marine-derived fungi. Chemosphere, 2018, 197: 651-660. DOI:10.1016/j.chemosphere.2018.01.054 |
| [39] | Tadkaew N, Hai FI, McDonald JA, Khan SJ, Nghiem LD. Removal of trace organics by MBR treatment: the role of molecular properties. Water Research, 2011, 45(8): 2439-2451. DOI:10.1016/j.watres.2011.01.023 |
 2021, Vol. 61
2021, Vol. 61